Mit und ohne Sicherheitsmerkmal in der Übergangszeit
Seit dem 9. Februar gilt die neue EU-Richtlinie für Arzneimittel. In der Anlaufphase können Packungen mit und ohne Sicherheitsmerkmale im Umlauf sein.
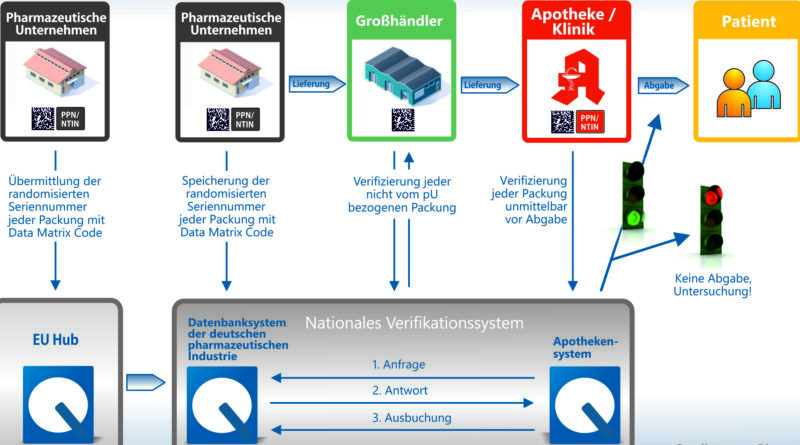
Rezeptpflichtige Arzneimittel müssen in der EU neuerdings einen Barcode auf der Verpackung tragen, mit dem sich per Scan in der Apotheke die Echtheit überprüfen lässt. Die Echtheitsprüfung in Deutschland hat Securpharm e.V. aufgebaut, ein Zusammenschluss von Pharma-, Großhandels- und Apothekerverbänden. Jede Packung hat dabei eine individuelle Seriennummer, die in das System eingespeist wird. Mit dem Scan der Codes lässt sich in der europaweiten Datenbank prüfen, ob die Nummer von einem Hersteller vergeben wurde oder womöglich eine Packung mit derselben Nummer schon über die Theke ging. 19 345 Apotheken, 346 Pharmaunternehmen, 887 Großhändler und 406 Krankenhausapotheken in Deutschland werden nach Angaben von Securpharm an das System angebunden. Der Bundesverband der Pharmazeutischen Industrie (BPI) schätzt die Investitionen alleine bei den Unternehmen auf mehr als eine Milliarde Euro.
Da die Packungen mit dem neuen Schutz ab 9. Februar erst nach und nach in den Handel kommen, wird es für eine Übergangszeit Packungen mit und ohne neue Sicherheitsmerkmale in den Apotheken geben. Dass bereits im Markt vorhandene Packungen bis zu ihrem Verfalldatum verkauft und verwendet werden können, betont die Branche. Im Markt werden sich Bestandsware und verifizierungspflichtige Arzneimittel für mehrere Jahre vermischen. Für die jetzige Anlaufphase hat Securpharm jetzt eine detaillierte Handlungsoption für pharmazeutische Großhändler herausgegeben. Ein Beispiel: Werden Verpackungen aus dem Bestand – somit ohne die neuen Sicherheitsmerkmale – über das neue System verifiziert, lösen sie eine „Systemrückmeldung“ aus, die als „Rote Lampe“ bezeichnet werden. Das System erkennt also einen Konflikt. Der pharmazeutische Großhändler könne diese Bestandsware, wenn er sich von ihrer Echtheit und Unversehrtheit überzeugt hat, annehmen, so die Empfehlung des Vereins.
Martin Bergen, Geschäftsführer von Securpharm e. V. erklärt: „Patientenschutz ist ein hohes Gut und für die Partner der Arzneimittelversorgung unverzichtbar. Wir werden die Sicherheit von Arzneimitteln mit dem neuen Schutzschild noch weiter erhöhen.“ Zunächst gehen in 26 EU-Mitgliedstaaten sowie in Norwegen, Island und Liechtenstein die Sicherheitssysteme in Betrieb. Bis 2025 kommen dann auch die Systeme Italiens und Griechenlands dazu. Grafikquelle Verifikationssystem: Securpharm e.V.